子宫内膜是一种能够在雌激素和孕酮的影响下每月经历脱落和再生而不形成疤痕的动态组织。Asherman综合征是由宫腔镜手术或反复人工流产造成的子宫内膜基底层损伤引起的一种妇科疾病,导致子宫内膜干细胞前体细胞丢失,并以病理性纤维组织替代受损区域,从而降低后续怀孕和活产率。因此,开发子宫内膜修复的新方法迫在眉睫。近年来,干细胞疗法在修复受损子宫内膜的研究中表现出了巨大的应用潜力。子宫内膜上皮前体细胞(Endometrial epithelial progenitor cells,EEPCs)的植入对于子宫内膜的修复具有一定疗效,但由于EEPCs体外扩增能力弱、成活率低等缺陷造成的体内植入率低限制了临床应用。类器官技术的出现克服了体外扩增的限制,并保留了体内组织的特性。子宫内膜上皮细胞衍生的类器官(endometrial epithelium organoids,EEOs)表现出了修复受损子宫内膜的能力。然而,组织再生需要干/祖细胞以及周围生态位的协调动态重塑,提示了类器官与维持生态位成分的联合使用可能会提高类器官对受损子宫内膜的修复效率。间充质干细胞(Mesenchymal stem cells,MSCs)来源广泛,且由于其自我更新、低免疫原性和免疫调节功能而成为干细胞治疗的潜在细胞。其中,子宫内膜间充质干细胞(Endometrial mesenchymal stem cells,eMSCs)是一类子宫内膜内的干/祖细胞,可为子宫内膜细胞生态位的修复提供合适的微环境。人脱细胞羊膜(human acellular amniotic membrane,HAAM)保留了细胞外基质(Extracellular matrix,ECM)成分,因其低免疫原性和良好的生物相容性,近年在组织工程和再生医学领域得到了广泛应用。
2023年12月14日,bat365在线平台类器官研究院院长赵冰教授团队在Cell Transplantation杂志在线发表了题为“Multi-Lineage Human Endometrial Organoids on Acellular Amniotic Membrane for Endometrium Regeneration”的研究论文,他们开发了一种包含EEOs和eMSCs的多谱系子宫内膜类器官(multi-lineage endometrial organoids,MLEOs),探究了该类器官在修复受损子宫内膜和减缓细胞凋亡中的效率。随后,研究团队将MLEOs植入HAAM中形成MLEO-HAAM的复合结构,进一步研究表明MLEO-HAAM贴片能够有效修复机械磨损至基底层的损伤子宫内膜,并能改善妊娠结局,提出MLEO-HAAM贴片有望成为一种修复受损子宫内膜的有效方法。

研究人员首先将子宫内膜间充质干细胞(eMSCs)和子宫内膜上皮细胞(EEOs)在基质胶中共培养(图1-A),获得了能在体内良好扩增,并同时表达上皮细胞标志物 EpCAM和成纤维细胞标志物 Vimentin的多谱系子宫内膜类器官(MLEOs)(图1-B-C)。
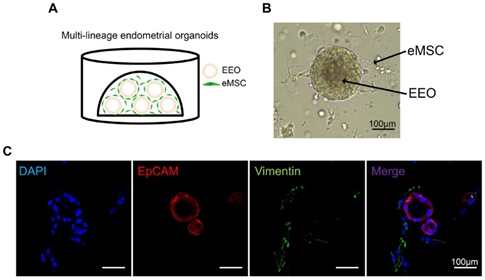
图1:MLEOs的建立和标记物检测。
为了进一步确定间充质细胞是否能作为干细胞微环境支持上皮干细胞的正常功能和自我更新。研究人员首先在能维持EEOs自我更新的体外扩增的3D基质胶培养体系中撤去了Rspo1和Noggin,发现该体系中EEOs无法增殖和自我更新。然而,当EEOs与eMSCs共培养时,Rspo1和Noggin的缺失并不影响类器官的自组装(图2-A)。免疫荧光检测显示,共培养组的类器官中表达增值标志物Ki67和干性标志物Sox9的细胞数量显著增多(图2-B)。RT-qPCR分析显示,共培养组的类器官中干性相关基因(Axin2和Sox9)表达水平明显上调(图2-C)。流式细胞术显示,共培养组中干性标志物SSEA-1阳性表达的细胞(图2-C)的比例明显增加。以上结果表明eMSCs提供了支持EEOs生长和自我更新的微环境。
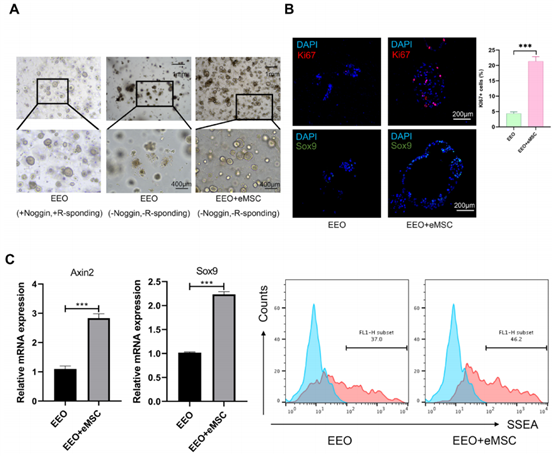
图2:eMSCs支持EEOs的生长和自我更新。
为了进一步明确MLEOs是否具有修饰受损子宫内膜的能力。研究人员首先通过刮宫手术建立了子宫内膜损伤的大鼠模型,随后将MLEOs 移植到受损子宫内,术后两周收集组织进行评估(图3-A)。H&E染色显示,相较于对照组,所有细胞治疗组(包含了单移植EEO组、单移植eMSC组以及单移植MLEO组)的子宫内膜厚度和腺体数量均显著改善,其中 MLEO组改善最明显(图3-B-D-E)。Masson三色染色显示,MLEO 组的纤维化面积显著低于其他组(图3-C-F)。这些结果表明,MLEOs 在修复受损子宫内膜方面具有显著效果。
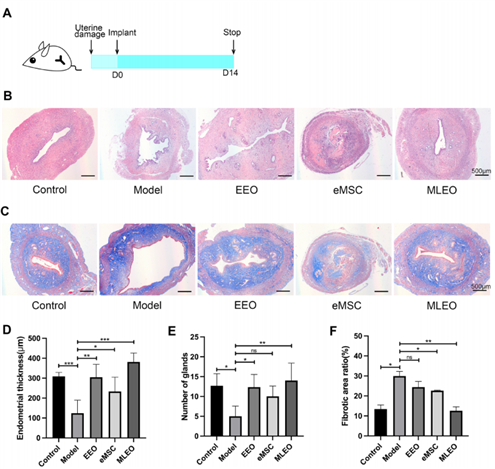
图3:MLEOs的子宫内膜修复效率的体内评估。
为了评估不同治疗方法的血管生成能力,研究人员收集的大鼠子宫组织中进行了内皮细胞标志物CD31的免疫组织化学染色。结果显示,MLEO 组的 CD31 表达显著高于其他组(图4-A-B)。RT-qPCR 分析显示MLEO 组的子宫内膜受容性标记基因 integrinβ3 表达最高(图4-C),该结果提示MLEOs 可能改善受损子宫的妊娠结局。
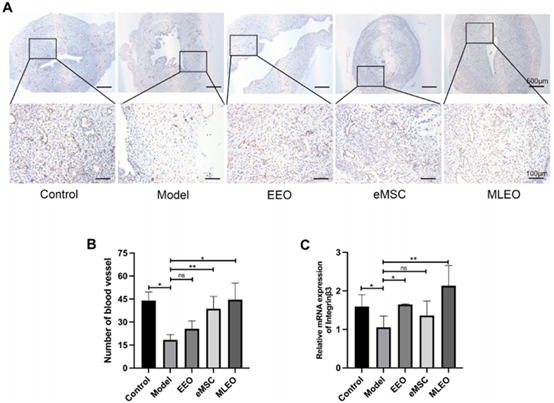
图4:MELOs的体内血管化和子宫受容性的评估。
为了进一步提高MELOs的修复效率,研究人员将MLEOs种植在HAAM上后形成MLEOs-HAAM贴片(图5)。为了进一步评估MLEO-HAAM贴片对子宫内膜修复的有效性,研究人员将子宫内膜损伤的大鼠模型分为三组:模型组(Model)、MLEO修复组和MLEO-HAAM修复组,随后进行了胚胎移植实验。结果显示,MLEO-HAAM组的着床胚胎数量最多(图6),表明MLEO-HAAM贴片能够有效修复新损伤的组织,改善妊娠结局。

图5:MLEOs-HAAM贴片示意图。
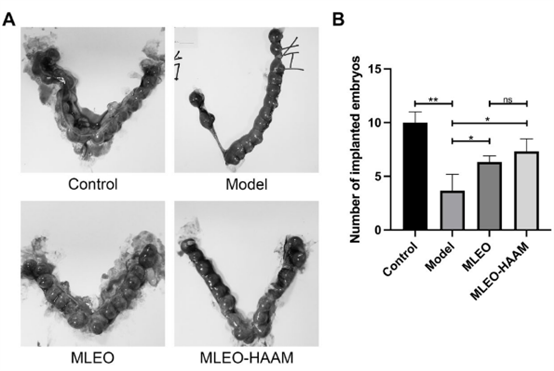
图6:MLEO-HAAM 贴片的妊娠结局评估实验。
综上所述,该研究表明多谱系子宫内膜类器官MLEOs能够促进子宫内膜再生、抑制纤维化,MLEOs具有较高的子宫受容性。研究团队开发的MLEO-HAAM贴片能有效改善子宫内膜受损小鼠的妊娠结局,有潜力成为临床治疗受损子宫内膜的新方法。未来的研究团队将集中在其他子宫内膜受损或宫腔黏连动物模型中验证 MLEO-HAAM 贴片的再生功能,以提高MLEO-HAAM的疾病治疗价值。
bat365在线平台类器官研究院院长赵冰教授为本文的共同通讯作者。该研究得到了国家自然科学基金,生命科学学院的教师资源项目(内蒙古大学),中国上海卫生委员会新兴跨学科研究项目,中国申康临床科技创新项目等经费支持。
作者简介

赵冰
bat365在线平台
赵冰,bat365在线平台类器官研究院院长,国家优青、国家重点研发计划“干细胞及转化研究”首席科学家(青年)。研究成体干细胞命运决定机制,发展类器官培育新策略。

