乳腺癌作为女性十大恶性肿瘤之首,在女性恶性肿瘤中发病率位居第一。基底样乳腺癌亚型预后不良,针对基底样乳腺癌的治疗有一定进展,如携带BRCA1/2突变的病人对铂类化疗和PARP抑制剂比较敏感;PD-L1/PD-1单克隆抗体对部分基底样乳腺癌也显示了较好的疗效;戈沙妥珠单抗(sacituzumab govitecan,简称SG)开启了基底样乳腺癌抗体偶联药物的新时代。但是因为基底样乳腺癌具有高度的异质性,这些治疗方法经常面临先天耐药和获得性耐药。因此,亟需研发高效、特异的靶向基底样乳腺癌的小分子化合物,探索联合用药方案,为基底样乳腺癌的治疗提供新策略,以期改善患者生存预后。
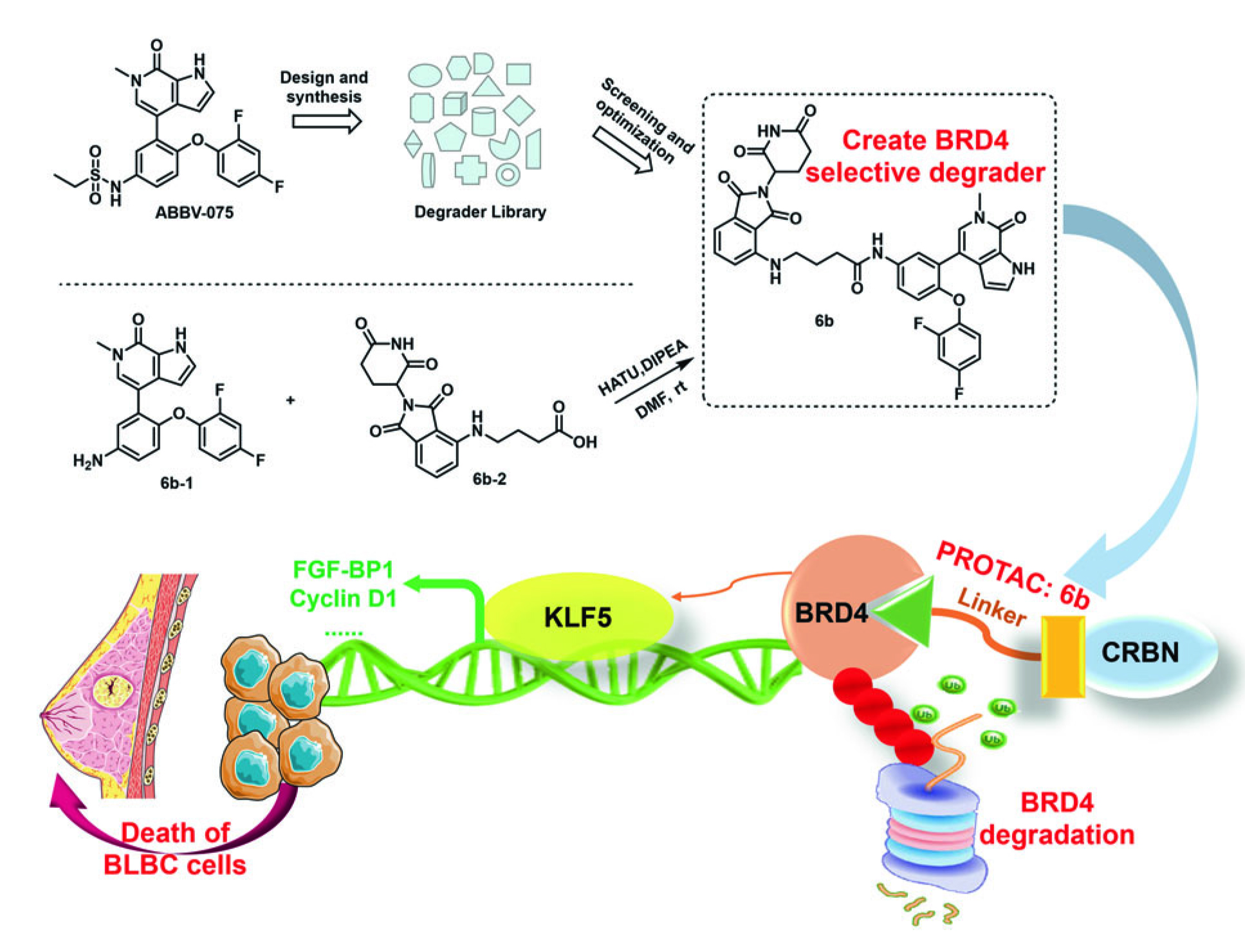
近年来,人们对利用蛋白降解靶向嵌合体(Proteolysis-targeting chimeras, PROTACs)技术在乳腺癌的治疗中呈现出较好的发展潜力,开发更为特异、高效的靶向乳腺癌的PROTAC,与现有临床药物联合应用可能是改善晚期乳腺癌不良预后的新策略。 其中,靶向雌激素受体ER的PROTAC药物ARV-471已经进入了治疗ER阳性晚期乳腺癌3期临床。组蛋白H3K27的乙酰化修饰是基因转录活化的典型特征,在超级增强子尤其显著富集,BRD4蛋白可以结合乙酰化H3K27,从而招募组装转录复合物启动基因转录表达,所以BRD4已经成为非常热门的抗癌药物靶点,多个BRD4小分子抑制剂如JQ-1,870和BRD4的 PROTAC化合物对肿瘤表现出很好的抑制作用。然而它们的成药性受到非特异性靶向其它BRD蛋白的限制。
最近,bat365在线平台生物医学工程研究院、bat365在线平台第三附属医院陈策实院长团队与清华大学药学院饶燏教授团队合作,在国际癌症研究领域的《Oncogene》杂志发表题为“BRD4-speci?c PROTAC inhibits basal-like breast cancer partially through downregulating KLF5 expression”的研究论文。

该研究基于CRBN泛素连接酶合成了一系列PROTAC化合物,评估了它们在乳腺癌中的抗癌活性。发现6b(BRD4 PROTAC)能特异性抑制BRD4的蛋白水平,而不降解BRD2和BRD3,促进BRD4进入泛素蛋白酶体途径降解,显著地抑制基底样乳腺癌细胞增殖,此外,6b在基底样乳腺癌异种移植小鼠模型和PDX模型中均显著抑制了肿瘤生长。
团队早期大量研究发现KLF5是基底样乳腺癌的关键促癌转录因子,而BRD4介导的超级增强子控制了KLF5在基底样乳腺癌高表达,BRD4小分子抑制剂如JQ-1,870和CDK7小分子抑制剂THZ1可以有效抑制KLF5在基底样乳腺癌表达,发挥抑癌作用(Inhibition of super enhancer downregulates the expression of KLF5 in basal-like breast cancers,Int J Biol Sci, 2019 Jun 10;15(8):1733-1742. doi: 10.7150/ijbs.35138)。基于此,团队研究发现6b可以有效抑制KLF5的表达,过表达KLF5可以部分降低6b的疗效,6b与KLF5抑制剂FZU-00,004(Discovery of novel mifepristone derivatives via suppressing KLF5 expression for the treatment of triple-negative breast cancer,Eur J Med Chem. 2018 Feb 25:146:354-367.)的联合使用在基底样乳腺癌细胞体内外模型中显示出相加效应。这些结果表明,BRD4特异性PROTAC可以通过下调KLF5有效抑制基底样乳腺癌,有望成为治基底样乳腺癌的一种新型药物。
bat365在线平台bat365在线平台生物医学工程研究院、第三附属医院陈策实研究员、清华大学药学院饶燏教授和深圳大学附属第一医院刘霞主任为该论文的共同通讯作者。深圳大学附属第一医院孔燕杰副研究员、清华大学吕兴文博士和中国科学院昆明动物研究所王露珍为该研究的共同第一作者。此项工作得到了科技部国家重点研发计划、国家自然科学基金委、云南省科技厅、深圳市和广东省科技厅的资助。
原文链接:https://doi.org/10.1038/s41388-024-03121-1
供稿:孔燕杰; 编校:张志毕; 审核:陈亚娟、陈策实

