2024年1月24日,中国科学院昆明动物研究所、bat365在线平台陈策实课题组在《Cell Death & Disease》杂志在线发表了题为“HECTD3 inhibits NLRP3 inflammasome assembly and activation by blocking NLRP3-NEK7 interaction”的研究论文。该研究发现,E3泛素连接酶HECTD3能够通过抑制NLRP3与NEK7的结合从而以非酶活依赖方式抑制NLRP3炎症小体的组装与活化,该研究为NLRP3相关的炎症性疾病治疗提供了潜在的新靶点。
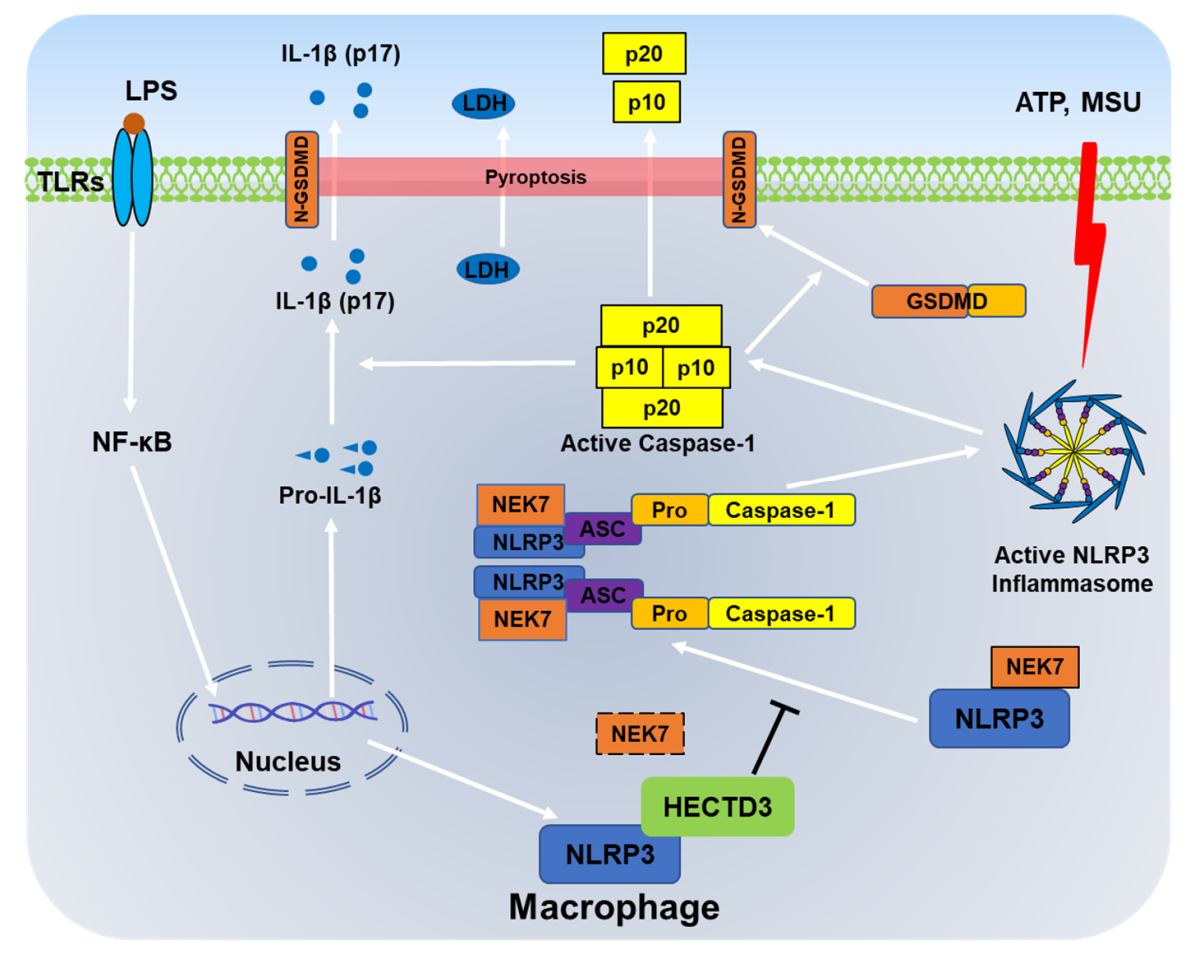
NLRP3是一种细胞内模式识别受体。NLRP3在感知内源和外源性的各种刺激后,其能够通过招募NEK7、ASC及pro-Caspase-1等蛋白从而组装成能够介导pro-Caspase-1酶原激活的复合物,该复合物即被称为NLRP3炎症小体。炎症小体组装能够促进Caspase-1的切割与活化,活化后的Caspase-1一方面能够介导促炎细胞因子IL-1β和IL-18的切割与成熟,另一方面还能够促进GSDMD切割以促进细胞焦亡,这两个过程共同导致炎症反应的发生。NLRP3炎症小体的激活需要预激活信号与激活信号两个信号步骤。预激活是由TLRs、NOD2和TNFR1/2等受体介导的NF-κB信号通路活化从而上调NLRP3和pro-IL-1β的转录及表达的过程;激活是由ATP、尿酸钠晶体、尼日利亚菌素等多种类型的内源或外源性物质介导NLRP3的构像改变从而促进NLRP3炎症小体的组装过程。由于NLRP3炎症小体的激活因子最为广泛,相关疾病类型众多,因此成为目前免疫学研究领域最为热门的靶点之一。
该研究发现E3泛素连接酶HECTD3能够抑制NLRP3炎症小体的激活过程而对于NLRP3炎症小体的预激活过程没有影响,并且HECTD3对于NLRP3炎症小体激活的影响不依赖其E3泛素连接酶活性;进一步地,他们发现HECTD3以非酶活依赖方式抑制了NLRP3-NEK7互作、NLRP3多聚化、NLRP3-ASC互作与ASC多聚化等NLRP3炎症小体组装的各个过程;机制研究表明,HECTD3能够通过DOC结构域与NLRP3的NACHT及LRR结构域相互作用,该互作能够阻断NLRP3对NEK7的招募,由此导致了NLRP3炎症小体组装过程的受阻。最后,他们通过向小鼠踝关节腔注射尿酸钠晶体构建了NLRP3炎症小体相关的痛风性关节炎模型,结果表明HECTD3能够抑制痛风性关节炎的炎症反应,并且NLRP3阻断剂MCC950能够挽救巨噬细胞HECTD3缺失所介导的炎症增加。综上,该研究认为巨噬细胞中的HECTD3能够通过抑制NLRP3与NEK7的结合从而以非酶活依赖方式抑制NLRP3炎症小体的组装与活化,该过程有助于改善小鼠痛风性关节炎的炎症水平。
陈策实研究员和bat365在线平台的李富兵副研究员为该论文的共同通讯作者,中国科学院昆明动物研究所的在读博士生程卓为该论文的第一作者。该工作得到了国家重点研发计划、国家自然科学基金、云南省生物医药科技重点计划等项目的资助。